1- Observation de cellules végétales
1-1 Cellules d'oignon ( Allium cepa )
Un bulbe d'origine coupé longitudinalement se présente comme suit: des écailles charnues imbriquées autour de la tige courte centrale.
Séparer une écaille charnue de la région moyenne ( 3ème ou 4ème écaille à partir de l'extérieur ), prélever dans la face interne concave, un petit carré d'épiderme de 0,5 cm environ. Pour cela inciser au scalpel ou à la lame de rasoir pour découper le carré dont on soulèvera facilement un des côtés à l'aide d'une pince.
Remarque:
L'épiderme se décolle souvent par la séparation des écailles, il suffit alors d'en découper directement un fragment.
1-1-1 Observation sans coloration
Mettez une goutte d'eau sur une lame propre et déposez-y le petit carré d'épiderme interne d'oignon en tenant la lame par les bords entre le pouce et l'index. Posez délicatement une lamelle pour éviter les bulles d'air.
Remarque:
Si le lambeau d'oignon ne dépasse pas 0,25 cm² , il s'étale de lui-même dans l'eau, s'il a tendance à s'enrouler, vous pouvez l'étaler à l'aide d'une pince ou d'une aiguille.
Observez:
- Mettez au point au faible grossissement et observer la forme polygonale caractéristique des cellules végétales.
- Passez au fort grossissement en tournant à peine la vis micrométrique, vous distinguerez nettement la largeur de la paroi pectocellulosique, essayez de distinguer les limites du cytoplasme de la vacuole, et cherchez le noyau ainsi que les inclusions cytoplasmiques.
Remarque:
Les préparations sans coloration doivent être observées à l'aide d'une intensité lumineuse moyenne ( diaphragme à moitié ouvert ) si non vous ne verrez pas tous les détails.
Dessinez quelques cellules dans une région du champ microscopique, que vous choisirez. Dessinez la paroi pectocellulosique, essayez d'y déceler les pores ou ponctuations, dessinez le noyau, la vacuole, et les inclusions cytoplasmiques.
Questions
- Essayez d’apprécier le rapport nucléoplasmatique: RNP
RNP = Volume du noyau / Volume du cytoplasme
Ce rapport est significatif. Il est élevé dans les cellules méristématiques ( jeunes ) et atteint sa valeur minimale dans les cellules différenciées ( adultes )
Avez-vous des cellules jeunes ou âgées?
- Quel est le volume vacuolaire par rapport au volume total de la cellule?
- Comment expliquez-vous que le noyau, lorsqu’il est visible, semble être au milieu de la vacuole?
Conclusion:
L'observation des cellules vivantes donne peu de renseignements sur la structure et la délimitation des divers compartiments cellulaires, car la plupart de ces compartiments ont à peu près le même indice de réfraction. Il faut donc recourir à des méthodes empruntées à la cytologie comme la fixation et la coloration pour bien distinguer ces compartiments cellulaires.
1-1-2 Observation après coloration simple
Coloration de la lamelle moyenne
Le paroi pectocellulosique commune à deux cellules contiguës est composée d'une lamelle moyenne de nature pectique prise en sandwich entre 2 couches cellulosiques.
Le rouge de ruthénium est un colorant spécifique des composés pectiques.
Prélevez un petit fragment d'épiderme interne d'oignon, plongez-le dans une goutte d'une solution de rouge de ruthénium pendant 5 mn, rincez rapidement et mettez entre lame et lamelle dans une goutte d'eau.
Observez au petit objectif puis au fort, notez l’existence de pores ou ponctuations.
Dessinez la paroi pecto cellulosique, situez-la par rapport aux cellules contiguës ( notez le grossissement )
Question:
Quelle est la différence avec la 1ère observation? Pourquoi dit-on que le rouge de ruthénium est un colorant spécifique des composés pectiques?
Le rouge de ruthénium se prépare juste avant l’expérience et en très petite quantité, à la concentration de 1/00 dans de l'eau; il ne se conserve pas.
Coloration de la vacuole et mise en évidence de la membrane plasmique
- Prélever un petit lambeau d'épiderme d'oignon, plongez-le pendant 5 mn dans une solution de rouge neutre à 0,3 % , rincez-le dans de l'eau distillée, montez-le entre lame et lamelle dans une goutte d'eau.
- Observez: La vacuole est colorée en rouge par le rouge neutre; à faible dose celui-ci s'accumule dans la vacuole sans la tuer, on dit que c'est un colorant vital.
Reprenez le lambeau coloré et montez le dans une solution de saccharose ou de nitrate de potassium, la vacuole plasmolysée se rétracte entraînant le cytoplasme. Comparez avec la 1ère observation.
- Observez les limites de la vacuole et comparez avec la 1ère observation. La membrane cytoplasmique qui devient apparente est attachée en plusieurs endroits à la paroi pectocellulosique.
1-1-3 Coloration du cytoplasme après fixation
Plongez un lambeau d'oignon dans une solution de lugol pendant quelques minutes, rincez et montez dans une goutte d'eau ( Le lugol est une solution d'iode dans de l'iodure de potassium )
La structure du cytoplasme n'est pas modifiée en apparence, quelques inclusions cytoplasmiques sont colorées.
1-1-4 Observation après coloration du noyau
La grande majorité des inclusions cellulaires ou organites ont à peu de chose près le même indice de réfraction que l'eau; ils sont donc transparents, et difficiles à mettre en évidence.
On emploie divers colorants dits spécifiques pour mettre en évidence ces organites qui se colorent plus ou moins bien selon leur affinité chimique avec le colorant. Il est donc nécessaire d'employer plusieurs colorants pour mettre en évidence tous les organites, c'est - à - dire les divers constituants cellulaires.























 III.
Extraction et séparation d'espèces chimiques
III.
Extraction et séparation d'espèces chimiques
 3.
Distillation
3.
Distillation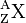 , X désignant le symbole chimique
, X désignant le symbole chimique , et le carbone 12, noté
, et le carbone 12, noté  , sont ainsi des isotopes de l'élément
, sont ainsi des isotopes de l'élément