Deux isotopes ont le même nombre Z de protons et appartiennent donc au même élément chimique. Ce qui distingue deux isotopes est leur nombre de masse A différent. Le nombre de masse d'un atome est le nombre de nucléons — protons et neutrons — que contient le noyau de cet atome ; la différence de nombre de masse entre isotopes provient de la différence du nombre de neutrons N.
Les isotopes sont désignés par leur symbole chimique, complété :
- par leur nombre de masse A (égal au nombre de nucléons de l'atome) placé en haut et à gauche du symbole, et
- par le numéro atomique Z, placé en bas et à gauche du symbole.
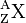 , X désignant le symbole chimique
, X désignant le symbole chimiqueLe carbone 14, noté
 , et le carbone 12, noté
, et le carbone 12, noté  , sont ainsi des isotopes de l'élément carbone. Le numéro atomique est généralement omis, car redondant avec le symbole chimique.
, sont ainsi des isotopes de l'élément carbone. Le numéro atomique est généralement omis, car redondant avec le symbole chimique.Les isotopes les plus courants de l'hydrogène sont également notés selon ce principe : 2H pour le deutérium et 3H pour le tritium ; l'IUPAC admet toutefois (mais sans le recommander) l'usage respectivement des symboles D et T pour le deutérium et le tritium, en raison de l'effet isotopique marqué de ces isotopes par rapport au protium. On peut également représenter les isotopes par leur nom suivi par leur nombre de masse séparé par un espace (et non un tiret, contrairement à l'anglais) : par exemple, carbone 14, oxygène 18, fer 56, etc.
Propriétés
Les propriétés chimiques des isotopes d'un même élément sont presque identiques car ces isotopes ont le même nombre d'électrons (et de protons). Il existe cependant de légers effets isotopiques sur les vitesses de réaction.En revanche, comme le noyau ne comporte pas le même nombre de neutrons, la masse des atomes varie. Cette différence de masse atomique permet de séparer les isotopes d'un même élément par spectrométrie de masse ou par centrifugation et ainsi de les distinguer.
Stabilité
Il existe 80 éléments chimiques ayant au moins un isotope stable, de l'hydrogène 1H au plomb 82Pb. Le technétium 43Tc et le prométhium 61Pm n'ont, quant à eux, aucun isotope stable.Le noyau d'un atome est constitué d'une part de protons qui se repoussent sous l'action de l'interaction électromagnétique (les charges électriques de même nature se repoussent) mais qui s'attirent sous l'action de l'interaction forte, et d'autre part de neutrons qui s'attirent sous l'action de l'interaction forte. Dans un noyau, la stabilité est donc assurée par l'interaction forte, et par les neutrons qui, éloignant les protons les uns des autres, diminuent l'intensité de la répulsion électromagnétique entre les protons, d'où les propriétés suivantes :
Pour ces centaines d'isotopes naturels, les nombres respectifs de protons et de neutrons semblent respecter certaines règles :
- le nombre de neutrons est à peu près égal à celui des protons pour les éléments légers ; à partir du 21Sc, le nombre de neutrons devient supérieur au nombre de protons, l'excédent dépassant 50% pour les éléments les plus lourds ;
- certains noyaux particulièrement stables contiennent des protons ou des neutrons (ou les deux) en nombre égal à un des « nombres magiques » suivants :
Selon les théories actuelles, ces valeurs correspondraient à des noyaux possédant des couches complètes de neutrons ou de protons.
Utilisation ; analyse isotopique
Un exemple très connu de couple d'isotopes est constitué par le carbone : le carbone est présent en grande majorité sous son isotope de poids atomique 12 (le « carbone 12 ») ; d'autre part, on peut trouver en faible quantité l'isotope de poids atomique 14 (le carbone 14), qui est chimiquement strictement équivalent au carbone 12, mais qui est radioactif. En effet, les neutrons supplémentaires du noyau rendent l'atome instable. Il se désintègre en donnant de l'azote et en émettant un rayonnement bêta.La proportion de l'isotope stable par rapport à l'isotope instable est la même dans l'atmosphère et dans les tissus des êtres vivants mais elle varie régulièrement au cours du temps à la mort de l'individu puisque les échanges sont stoppés. C'est sur cette variation que se base la plus connue des méthodes de datation radioactive par couple d'isotopes, qui est la méthode de datation par le carbone 14. C'est certainement l'application la plus importante du concept d'isotope. Les traceurs isotopiques sont une autre application de ce concept.
Une application majeure est la séparation des isotopes 235U et 238U de l'uranium, aussi appelé enrichissement ; cette séparation est obtenue par diffusion gazeuse ou par centrifugation d'hexafluorure d'uranium UF6.
Séparation des isotopes par centrifugation
La centrifugation est obtenue par une cascade de centrifugeuses qui élèvent petit à petit le taux de U 235 dans le mélange U 235-U 238 qui peut servir pour un enrichissement de 5 % à des applications civiles de fission ou à 90 % pour des applications militaires.Les centrifugeuses sont des cylindres étroits tournant à vitesse élevée. La force centrifuge est égale à M.ω2.r où M est la masse unitaire, ω la vitesse angulaire de rotation et r le rayon du cylindre. Pour éviter une rupture mécanique on choisit r petit et, afin d'avoir une force appréciable, on choisit ω très élevée (la force est proportionnelle au carré de la vitesse de rotation). Le taux d'enrichissement recherché est obtenu en disposant une quantité importante de centrifugeuses en série (des milliers). Ce mode de séparation est utilisé par des industriels canadiens, russes, européens.



0 commentaires:
Enregistrer un commentaire